Leucemias Linfoides Agudas: 30% de todos los casos ocurren en mayores de 18 años

Por: Dra. Karla Adriana Espinosa Bautista, Coordinadora de Clínica de Leucemias Linfoblásticas, Instituto Nacional de Cancerología INCan
Hematologia.mx.- Las Leucemias Linfoides Agudas (LLA) son enfermedades que se caracterizan por la proliferación clonal de células progenitoras hematopoyéticas de linaje específico linfoide. Se pueden presentar con manifestaciones clínicas diversas, asociadas a la infiltración por blastos linfoides a la médula ósea y otros órganos [1].
Para realizar un adecuado diagnóstico, clasificación y tratamiento, además de la identificación de blastos por morfología, se requieren estudios de Citometría de Flujo (CF), Análisis de Hibridación In Situ Fluorescente (FISH), PCR (Reacción en Cadena de la Polimerasa), Cariotipo y Estudios Moleculares Específicos. [2]

Epidemiología
De acuerdo con información de Globocan, en México se diagnosticaron 6,406 nuevos casos de leucemias agudas durante el 2018, [3] y se estima que el 51% son de origen linfoide [4]. El 30% de todos los casos de LLA ocurren en mayores de 18 años y, representan la décima neoplasia más frecuente en adultos.
Clasificación
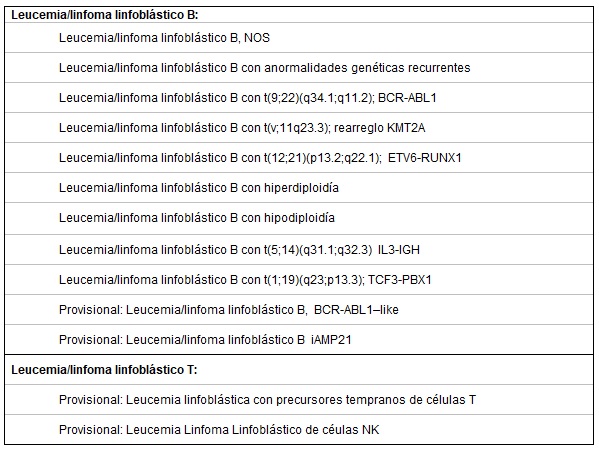
La revisión de la Organización Mundial de la Salud (OMS) 2016 [5], clasifica a las leucemias linfoblásticas en diferentes entidades:
Pronóstico
El pronóstico de la LLA es heterogéneo y depende de diferentes características clínicas y biológicas de la enfermedad, incluyendo la edad de diagnóstico, comorbilidades, así como alteraciones citogenéticas y moleculares [6].
En la población pediátrica, la Supervivencia Libre de Enfermedad (SLE) se reporta mayor al 85% a 5 años, mientras que, en el grupo de adolescentes y adultos jóvenes (AAJ), la SLE es de 60% y en adultos mayores, de 20 a 40% a 5 y 3 años, respectivamente [7-10]
Uno de los factores que explica las diferencias en el pronóstico, entre los grupos etarios, es una mayor aprevalencia de alteraciones citogenéticas de alto riego, incluyendo: hipodiploidía (<44 cromosomas); rearreglos KMT2A (t(4;11) u otras); t(v;14q23)/IgH; t(9;22)(q34;q11.2): BCR/ABL1 (definida como alto riesgo antes de la era de inhibidores de tirosina-cinasa); cariotipo complejo (5 o más anormalidades cromosómicas); amplificación intracromosómica del cromosoma 21 (iAMP21) y “Philadelphia Like” [11,12].
Otro aspecto que ha demostrado tener un impacto en el pronóstico de la LLA, es la de enfermedad residual [13,14]. La presencia de Enfermedad Medible Residual (EMR), identificada por técnicas de PCR o CF, es considerada el factor pronóstico independiente más importante, y debe ser tomado en cuenta para realizar ajustes en la intensidad de la quimioterapia, así como en la decisión de incluir en el tratamiento, el trasplante de células progenitoras hematopoyéticas (TCPH).
Tratamiento
Las modificaciones en el tratamiento de LLA en adultos, han favorecido el pronóstico de estos pacientes. La incorporación de protocolos con base pediátrica y el uso de L-Asparaginasa en población AAJ, han demostrado mejorar la supervivencia libre de enfermedad [15-17]
Así mismo, el desarrollo de nuevos medicamentos dirigidos contra blancos moleculares, incluyendo inhibidores de tirosina-cinasa de BCR/ABL, así como anticuerpos contra CD20, CD22 y CD19, han mejorado la supervivencia de los adultos con LLA
El reporte del GTLA (Grupo de Trabajo en Leucemias Aguda), que conforma un registro de cinco instituciones de la Ciudad de México, logró reunir una cohorte de 559 pacientes adultos, reportando respuestas completas de 75.3% y una mediana de Supervivencia Global de 12.9 meses, inferior a lo reportado en otras series internacionales. La mediana de edad al diagnóstico fue de 28 años. El principal esquema de quimioterapia utilizado fue HCVAD (47%), 52% de la población fue considerada de alto riesgo, sin embargo solo el 6% fue llevado a TCPH.
Con base en estos resultados, en México se ha buscado modificar el protocolo de quimioterapia, priorizando el uso de tratamientos con base pediátrica, la búsqueda de EMR por citometría de flujo, el empleo de terapias dirigidas y la adecuada estratificación de riesgo para identificar a los pacientes que se beneficiarán de TCPH.
Referencias
Farber S, Diamond LK, Mercer RD, Sylvester RF, Wolff JA. Temporary Remissions in Acute Leukemia in Children Produced by Folic Acid Antagonist, 4-aminopteroyl-glutamic acid (Aminopterin). 1948;238(23):787-793.
Hoelzer D, Bassan R, Dombret H, et al. Acute lymphoblastic leukaemia in adult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2016; 27 (Supplement 5): v69–v82
https://gco.iarc.fr/today/data/factsheets/populations/484-mexico-fact-sheets.pdf
Gomez-Almaguer D, Marcos-Ramirez ER, Montano-Figueroa EH, et al: Acute leukaemia characteristics are different around the world: the Mexican perspective. Clin Lymphoma Myeloma Leuk 2017; 17: 46–51
Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood. 2016;127(20):2391-2405.
Hoelzer D, Bassan R, Dombret H, et al. Acute lymphoblastic leukaemia in adult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2016; 27 (Supplement 5): v69–v82
Sasaki K, Jabbour EL, O’Brien SM, et al. Outcome of Patients with Philadelphia Chromosome-Negative Acute Lymphoblastic Leukemia (ALL) By Age Group over 35 Years: A Single Institution Experience, Blood, 2016,128:3975.
Aldoss I, Forman SJ, Pullarkat V. Acute Lymphoblastic Leukemia in the Older Adult. J Oncol Pract 2019; 15:67-75
Jabbour E, O’Brien S, Konopleva M, Kantarjian H. New insights into the pathophysiology and therapy of adult acute lymphoblastic leukemia. Cancer. 2015;121(15):2517-2528
Roberts KG. Genetics and prognosis of ALL in children vs adults. Hematology Am Soc Hematol Educ Program. 2018; (1):137-145.
Harvey R. and Tasian S. Clinical diagnostics and treatment strategies for Philadelphia Chromosome-like acute lymphoblastic leukemia. Blood Advances. 2020; 4(1): 218-228
Herold T, Schneider S, Metzeler KH, et al. Adults with Philadelphia chromosome-like acute lymphoblastic leukemia frequently have IGH-CRLF2 and JAK2 mutations, persistence of minimal residual disease and poor prognosis. Haematologica. 2017;102(1):130-138
DiGiuseppe Joseph A., Wood Brent L. Applications of Flow Cytometric Immunophenotyping in the Diagnosis and Posttreatment Monitoring of B and T Lymphoblastic Leukemia/Lymphoma. Cytometry B Clin Cytom. 2019; 96(4): 256-265
Advani AS, Copelan EA. Navigating the nexus of MRD and novel agents in ALL. Hematology Am Soc Hematol Educ Program. 2019;2019(1):9-16.
Siegel SE, Stock W, Johnson RH, et al. Pediatric-Inspired Treatment Regimens for Adolescents and Young Adults With Philadelphia Chromosome-Negative Acute Lymphoblastic Leukemia: A Review. JAMA Oncol. 2018;4(5):725-734.
Rytting ME, Jabbour EJ, O’Brien SM, Kantarjian HM. Acute lymphoblastic leukemia in adolescents and young adults. Cancer. 2017;123(13):2398-2403.
Stock W, Luger SM, Advani AS, et al. A pediatric regimen for older adolescents and young adults with acute lymphoblastic leukemia: results of CALGB 10403. Blood. 2019; 133:1548-1559
Maury S, Chevret S, Thomas X, et al. Rituximab in B-lineage Adult Acute Lymphoblastic Leukemia. N Engl J Med 2016; 375:1044-53
Chang J, Douer D, Aldoss I, Vahdani G, Jeong AR, Ghaznavi Z, Zhang S, Yaghmour G, Lee KJ, Weissman A, Akhtari M. Combination chemotherapy plus dasatinib leads to comparable overall survival and relapse free survival rates as allogenic hematopoetic stem cell transplantation in Philadelphia positive acute lymphoblastic leukemia. Cancer Medicine 2019. 8(6):2832-2839
Kantarjian H, Jabbour E, Topp MS. Blinatumomab for Acute Lymphoblastic Leukemia. N Engl J Med. 2017;376(23):e49

