Día Mundial de la Enfermedad de Chagas: visibilizando la epidemia oculta de México, América Latina y el Caribe


MSP José Noé Rizo Amézquita Director de la Sección Técnica de Determinantes Sociales de la Sociedad Mexicana de Salud Pública (SMSP). Investigador en Salud y Seguridad Social de la Conferencia Interamericana de Seguridad Social (CISS)

Dr. Fabián Correa Morales Director de la Sección Técnica de Enfermedades Transmitidas por Vectores e Intoxicaciones por Artrópodos de la SMSP. Director del Programa de Enfermedades Transmitidas por Vectores e Intoxicación por Artrópodos Venenosos del CENAPRECE

Mtra. Marcia Leyva Gastelum Directora de la Sección Técnica de Investigación en Salud de la SMSP. Directora del Laboratorio Estatal de Salud Pública (LESP) del Estado de Sonora
A partir del 2020, la Organización Mundial de la Salud (OMS) definió el 14 de abril como el Día Mundial de la Enfermedad de Chagas. Esta conmemoración tiene como objetivo aumentar la conciencia pública de esta enfermedad y crear una conciencia global para la generación de acciones globales en su contra. La enfermedad de Chagas fue descubierta hace más de un siglo (Velasco-Castrejón & Rivas-Sánchez, 2008). Sin embargo, actualmente es clasificada como una de las enfermedades tropicales desatendidas, puesto que sigue siendo un problema de salud pública con graves y, a menudo irreversibles, consecuencias (OMS, 2020).

El parásito causante de esta enfermedad es el Trypanosoma cruzi, y se estima que en las América se encuentran entre 6 y 8 millones de personas infectadas por este parásito, de las cuales, solo 3 de cada 10 tiene conciencia de ello. Esto implica que el 70% de la población infectada ignora su condición debido a la ausencia de síntomas clínicos y de las cuales aproximadamente 10,000 mueren al año producto de complicaciones clínicas de dicha enfermedad (Organización Panamericana de la Salud (OPS), 2021; OPS, 2023). No obstante, el número real de casos podría ser mayor, debido al subdiagnóstico crónico propio de esta infección, debido a la falta de sintomatología clara que indique su presencia. En muchas ocasiones, la enfermedad permanece silenciosa y no es sino hasta alcanzar las fases avanzadas, que se caracterizan por complicaciones como miocardiopatías chagásicas, arritmias letales o megavísceras digestivas, que es finalmente diagnosticada (Rassi, Rassi & Marin-Neto, 2010). Lo anterior implica la necesidad de un diagnóstico y tratamiento oportuno.
Cuando se habla de la Enfermedad de Chagas en la región de las Américas, un artículo publicado hace más de 10 años, lamentablemente, sigue vigente (Ventura-García et al., 2013). En dicho artículo se muestra a la Enfermedad del dengue como un modelo estructural de las desigualdades socioeconómicas y de los sistemas de salud de las Américas, región de la cual es endémica y que las constantes migraciones han extendido su presencia a zonas previamente no afectadas.
Con este artículo, el autor pretende sumarse a las acciones del día Mundial de la Enfermedad de Chagas, a fin de concientizar a la población sobre la importancia del conocimiento de su forma de transmisión, sus síntomas y las acciones de prevención y contención requeridas.
¿Qué es la enfermedad de Chagas?
Ocasionada por el protozoario Trypanosoma cruzi (ver Figura 1, inciso 4; tomado de Centers for Disease Control and Prevention CDC, 2022) alojado en los insectos triatominos (Triatominae; Figura 2), es una afección parasitaria crónica endémica en 21 países de América Latina; aunque, como se mencionó antes, los flujos migratorios han ocasionado su dispersión en regiones en las que antes no se presentaba. Entre estos países se encuentran Estados Unidos, Canadá, España, Italia, Francia, Suiza, Australia y Japón.
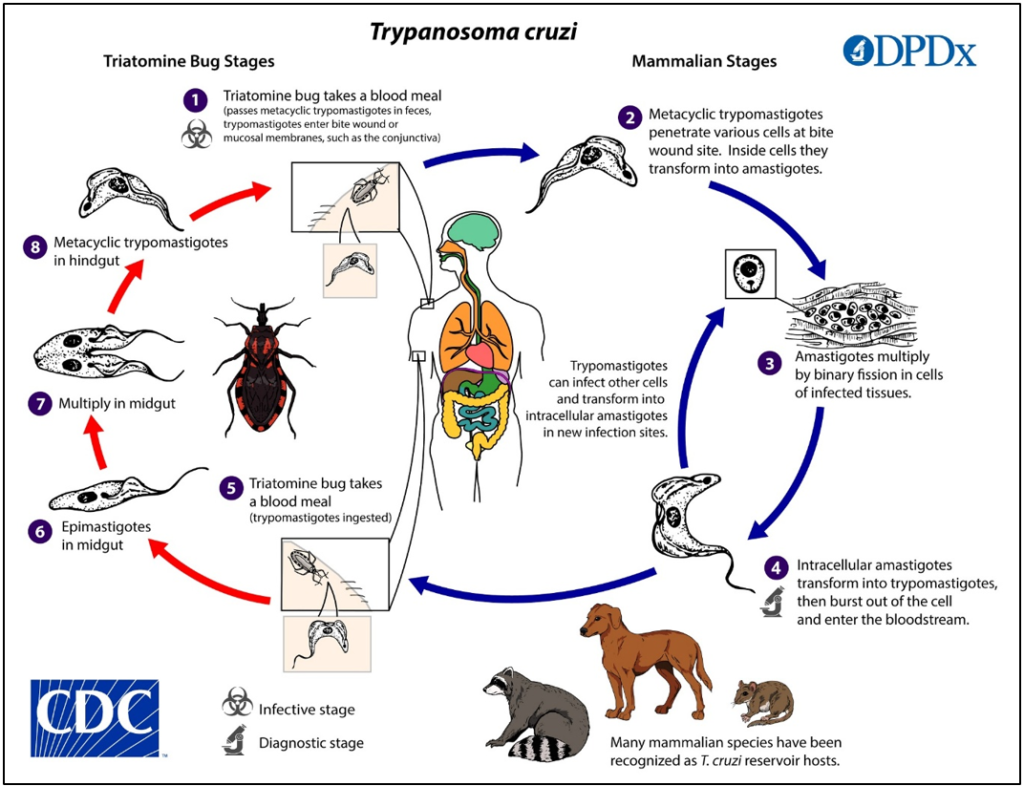

Su transmisión es por vectores, principalmente los insectos triatominos, también llamados “chinches besuconas”, que transmiten el parásito al picar y defecar en una herida presente en el hospedador (o huésped). Sin embargo, se han identificado otros mecanismos de transmisión como lo son las transfusiones sanguíneas, el trasplante de órganos de un donador infectado al receptor del órgano, el consumo de alimentos contaminados y la transmisión de madre a hijo durante la gestación (Peña-Callejas et al., 2022).
El ciclo de esta enfermedad se compone de dos fases, la Fase aguda y la Fase crónica. La Fase aguda sucede entre 6 y 8 meses después de la infección. Generalmente es asintomática, aunque se pueden presentar síntomas leves entre los que se incluyen fiebre, malestar general y el aumento de ganglios linfáticos. Puede presentarse también un changoma en el lugar de la picadura o, si ésta ocurrió en un área cercana a los ojos, un signo de Romaña por el contacto con las heces del vector. El signo de Romaña consiste en la inflamación del párpado, indoloro y de inicio súbito que puede acompañarse de conjuntivitis e inflamación de ganglios cercanos. Esta fase puede permanecer inactiva incluso por años. Sin embargo, posteriormente puede ocurrir la Fase Crónica. Esta fase sucede entre el 30-40% de los infectados y se caracteriza por diversas complicaciones cardíacas, digestivas y neuronales. La complicación más común es la cardiopatía chagásica crónica, que incluye miocardía dilatada, insuficiencia cardiaca, arritmias, tromboembolismos e incluso la muerte súbita. Las complicaciones digestivas incluyen el megacolon o dilatación anormal del colon y el megaesófago o dificultad para tragar. Finalmente, las complicaciones neuronales abarcan alteraciones cognitivas y accidentes cerebrovasculares ocasionados por embolias cardiacas (Peña-Callejas et al., 2022).
Prevención, atención y tratamiento de la Enfermedad de Chagas
Tanto la OMS como la OPS han considerado la Enfermedad de Chagas como una enfermedad tropical desatendida que afecta principalmente a habitantes principalmente de poblaciones rurales o marginadas que presentan condiciones socioeconómicas y socioculturales desfavorables. Estos factores condicionan favorablemente su propagación y desfavorablemente la efectividad de su atención (Ventura-García et al., 2013).
El diagnóstico oportuno y su tratamiento son aspectos capitales en la lucha contra esta enfermedad. En la Fase aguda, medicamentos antiparasitarios como benznidazol y el nifurtimox son de probada eficacia para eliminar el parásito (OPS, 2020). Sin embargo, si se alcanza la Fase crónica, la eficacia de estos antiparasitarios disminuye, aunque sigue siendo recomendable para disminuir su progresión y la probabilidad de complicaciones clínicas graves (OMS, 2023).
En cuanto a la prevención, el factor principal tiene que ver con la contención del vector transmisor. Esto requiere de la fumigación con insecticidas de los lugares con presencia de triatominos, principalmente hogares, hoteles, hospitales u otros sitios que propicien las condiciones óptimas para el insecto. Dormir con mosquiteros o evitar la exposición de la piel a insectos es relevante, así como el consumo de alimentos cocidos, bien lavados y líquidos pasteurizados. Igualmente, el mantenimiento y limpieza regular de estos sitios, mediante la reparación de grietas y techos, evitar acumulación de objetos como colchones, cojines u otros objetos donde el parásito pudiera alojarse, es requerida (OPS, 2020). La atención veterinaria a las mascotas es también importante. Para el caso de centros de atención a la salud, es necesario el cribado de sangre y órganos en bancos de sangre y servicios de trasplantes. La atención y seguimiento durante la gestación mediante pruebas de detección es útil para detectar y atender oportunamente la posible transmisión del parásito de madre a hijo (CDC, 2023; OMS, 2023).
La Guía para el diagnóstico y el tratamiento de la enfermedad de Chagas (OPS, 2020) contempla diversas fases que van del diagnóstico hasta el seguimiento, considerando casos especiales como la atención durante la gestación. Un resumen esquemático de esta guía se muestra en la Figura 3.
La Enfermedad de Chagas como problema mundial

La Figura 4 muestra los países en donde la Enfermedad de Chagas es endémica y por tanto está presente; así como los países en los que también se encuentra presente, pero no es endémica. Para estos últimos, la transmisión no es vectorial. En cambio, su presencia se relaciona directamente con el flujo de migrantes provenientes de países endémicos y su transmisión es principalmente atribuible a transfusiones de sangre, trasplantes de órganos y transmisión congénita de madre a hijo (OPS, 2023).
Actualmente, se estima que en la región de las Américas la prevalencia de la Enfermedad de Chagas oscila entre 6 y 8 millones de personas, con alrededor de un 70% de personas infectadas sin diagnóstico (OPS, 2021; OPS, 2023). En países no endémicos, un metaanálisis con estudios publicados entre 2006 y 2023 evaluó la presencia de esta enfermedad en España, Italia, Estados Unidos, Suiza, Canadá, Francia, Alemania y Japón, así como el origen del flujo de migrantes portadores. Los resultados indicaron que, de 82,369 migrantes, un 3.5% (IC 95%: 2.5–4.7) eran portadores de la enfermedad; mayormente provenientes de Bolivia (n = 7,964 examinados; n = 1,715 portadores, 21%). El país mayormente afectado fue España (Nepomuceno de Andrade et al., 2024).

Los datos antes descritos colocan a la migración como uno de los principales factores responsables de la propagación de la enfermedad de Chagas a países no endémicos. Al mismo tiempo, la migración revela las carencias y desigualdades socioeconómicas que afectan a los países desde donde parten los flujos migratorios, así como las limitaciones en el acceso a los servicios de salud y la búsqueda de atención médica adecuada que condiciona una migración en condiciones de salud poco adecuadas por no recibir un diagnóstico adecuado ni un tratamiento oportuno.
Además, al ser considerada una enfermedad tropical desatendida, los portadores no buscan atención médica sino hasta llegar a la Fase crónica, cuando ésta ha causado ya daños irreversibles a los órganos, particularmente al corazón y al sistema digestivo. Este diagnóstico tardío es reflejo de la incapacidad de realizar pruebas diagnósticas eficaces y oportunas, principalmente en zonas rurales y en poblaciones marginadas.
Finalmente, otros factores que contribuyen a que la Enfermedad de Chagas sea actualmente un problema global es la baja inversión en investigación para el desarrollo de tratamientos de mayor eficiencia, así como de limitadas estrategias y campañas de prevención. Igualmente, la acelerada urbanización que lleva a grandes concentraciones de habitantes favorece una mayor y más rápida propagación. Y, por último, el cambio climático crea condiciones cada vez más favorables en los ecosistemas que favorecen la proliferación de vectores y la expansión del riesgo de transmisión en nuevas zonas (Ventura-García et al., 2013).
La enfermedad de Chagas en México
Con base en el contenido del reporte epidemiológico de la semana 13 de 2025, el acumulado de casos de Enfermedad de Chagas aguda y crónica fueron, respectivamente, 12 y 175 casos en 2024. Para 2025, el acumulado en el mismo orden, aguda y crónico, son 6 y 102 hasta la semana 13, de 23 al 29 de marzo del 2025 (Gobierno de México, 2025). La Figura 5 y Figura 6 muestra la distribución geográfica de casos agudos y crónicos, respectivamente. Debe llamar la atención tanto el aumento de casos de enfermedad crónica frente a aguda, así como su mayor dispersión geográfica, principalmente hacia la zona norte del país. Este dato es consistente con la interacción entre el periodo silencioso de la enfermedad, que puede durar incluso años, así como los flujos migratorios del sureste del país hacia la zona norte. Igualmente, es probable que algunos migrantes portadores de la Enfermedad de Chagas logren cruzar la frontera hacia los países vecinos, Estados Unidos de Norteamérica y Canadá, y con ello propaguen la enfermedad, en principio endémica a la región de las Américas, es decir, México, Latinoamérica y el Caribe.


Hay que considerar que los datos oficiales y las estimaciones provenientes de la literatura científica distan profundamente. Shelly et al. (2016) contrastaron ambas fuentes y resumieron las diferencias de edad y sexo para los casos de Chagas y la mortalidad entre 1995 y 2013 y entre 1982 y 2010, respectivamente. Sus datos arrojaron un total de 6,494 casos oficialmente reportados, con una mayor prevalencia en adultos de 25 a 44 años (47.3%), y una mayor mortalidad en mayores de 45 años (85.5%). Adicionalmente, los estados del sur de México presentaron la mayor carga de la enfermedad, con una distribución espacial en aumento. Todo ello en contra de los datos oficiales que reportan 900 casos y 40 muertes anuales.
Estos resultados y perspectiva son consistentes con el trabajo de (), quienes refieren la posibilidad de personas infectadas con la Enfermedad de Chagas en México oscile entre 1.1 y 4 millones. Esto implica un alto riesgo de transmisión vía la donación de sangre y órganos, que pasa desapercibido por las cifras oficiales. Estos autores utilizaron un cribado serológico en diversos bancos de sangre, sobre n = 515,038 muestras de suero de donantes de sangre e identificaron como positivos para Trypanosoma cruzi a 1,210 donantes. (i.e., 0.23%; IC: 95% 0.22-0.25%). El 97% de estos donadores provenía de regiones no endémicas en el noreste del Estado de México, la Ciudad de México y el sur del Estado de Hidalgo y podrían estar ocasionando el contagio de esta enfermedad vía la transfusión sanguínea (González-Guzmán et al., 2022).
Estas cifras y condiciones deben ser atendidas por las instancias gubernamentales en México, particularmente por la notoria diferencia en la distribución geográfica entre los casos agudos y crónicos mostrada en las figuras 4 y 5. Es altamente posible que la región sureste del país sea donde inician el contagio, y su propagación se realice por el flujo migratorio que se realiza posteriormente, llevando la enfermedad a nuevos destinos y complicando el panorama de salubridad y salud pública en México.
Avances, desafíos y un llamado a la acción
En México, Latinoamérica y el Caribe, la Enfermedad de Chagas representa un desafío claramente poco abordado, al menos en México lo cual se evidencia desde el subregistro que se hace evidente en los datos oficiales. La subrepresentación de casos mantiene al Gobierno de México con un panorama incompleto de la gravedad de la epidemia. Esto a su vez, frena el impulso para establecer programas eficaces de prevención, atención y contención, sobre todo para el caso de la reducción de la propagación, que como se aprecia al comparar las figuras 5 y 6, comienza como aguda en la región sureste del país, pero se manifiesta como crónica en la región norte, con un mayor número de casos. Esto sugiere que la detección de casos en la fase aguda es ineficiente y solo hasta que se alcanza la fase crónica las autoridades sanitarias se percatan, registran y atienden. Esto con el riesgo del desenlace potencialmente fatal para las personas infectadas que llegan a esta fase.
Esto sucede en un contexto en el que, desde 2014, la ONG Médicos sin fronteras ha señalado que 6 de las 11 pruebas de diagnóstico rápido disponibles para esta enfermedad son altamente eficaces, sin requerir compleja infraestructura como podrían ser laboratorios o clínicas especializadas. Esto es capital para atender esta enfermedad en zonas rurales y marginadas, recurrentes en la región sureste de México. (Médicos Sin Fronteras, 2014). Entre las pruebas evaluadas se encuentran la prueba Serodia-Chagas y el kit ImmunoComb II Chagas Ab y la prueba rápida SD-Bioline Chagas Ab, todas ellas con un rendimiento superior al 90% probadas en zonas endémicas a esta enfermedad (Sánchez-Camargo et al., 2014). Igualmente, la OPS (2020) ha publicado guías actualizadas para el diagnóstico y tratamiento de esta enfermedad, mismas que se resumen de forma esquemática en Figura 7 y Figura 8.


Por otra parte, la Iniciativa de Medicamentos para Enfermedades Desatendidas (DNDi; DNDi, 2019) ha propuesto en México iniciativas para acrecentar el acceso a pruebas y terapias para el diagnóstico y tratamiento de la Enfermedad de Chagas. Al mismo tiempo, la OPS y la United for Innovation and Access to Development (Unitaid) establecieron una alianza a 5 años para invertir 2.6 millones de dólares a fin de reducir y eliminar la transmisión de la Enfermedad de Chagas materno infantil en América Latina. Con ello se busca establecer y consolidar una colaboración con el objetivo de mejorar las estrategias de diagnóstico, tratamiento y atención integral para mujeres y recién nacidos (Naciones Unidas México, 2022).
Sin embargo, la región de las Américas aún se enfrenta a una serie de barreras y desafíos a vencer entre las cuales se encuentran la escasez de recursos financieros, falta de infraestructura y recursos humanos especializados para el combate frente a esta enfermedad. Además, es necesario la concientización, información y educación de la población sobre esta enfermedad para que tomen acciones que logren diagnósticos y tratamientos oportunos. Adicionalmente, es necesario el establecimiento de políticas públicas sanitarias en relación con esta enfermedad que sean generales a todas las entidades del país, tales como la llamada “Ruta inversa” (Jiménez, 2023) la cual consiste en identificar y localidades para para identificar casos de Chagas en su fase aguda en todos los niños menores de 15 años y mujeres embarazadas, momento en el cual el tratamiento es más efectivo. Tampoco puede dejar de señalarse la publicación del Manual de procedimientos para la enfermedad de Chagas en México por la Secretaría de Salud, Centro Nacional de Programas Preventivos y Control de Enfermedades. (2019), el cual describe de manera detallada el protocolo de actuación de los sistemas de salud nacionales ante esta enfermedad.
La Figura 9 describe las acciones que el Gobierno de México podría tomar a fin de atender a la epidemia de la Enfermedad de Chagas. Actualmente se cuenta con una “Estrategia de Intervención Nacional para la Interrupción de la Transmisión Vectorial Intradomiciliaria de la Enfermedad de Chagas en México“, la cual se centra primordialmente en interrumpir la transmisión vectorial intradomiciliaria del T. cruzi. Este enfoque reconoce que la principal vía de infección en México es a través del contacto con las heces infectadas de las chinches triatominas que habitan en las viviendas, particularmente en zonas rurales y suburbanas con condiciones de vivienda precarias. Para lograr esta interrupción, la estrategia articula una serie de acciones coordinadas y secuenciales.

Un componente fundamental de la estrategia es la identificación de áreas prioritarias de intervención. Esto implica la realización de estudios epidemiológicos para determinar la prevalencia de la enfermedad en diferentes regiones del país. La identificación de localidades con alta endemicidad y presencia de vectores, permite enfocar los recursos y esfuerzos de manera más eficiente. En este sentido, la estrategia subraya la importancia de establecer una seroprevalencia base, a través de la toma de muestras serológicas en grupos vulnerables como niños y mujeres embarazadas, para comprender la magnitud del problema en las áreas de intervención. Una vez identificadas las áreas prioritarias, la estrategia se enfoca en el control vectorial. La principal herramienta para este control es el rociamiento integral de viviendas con insecticidas de acción residual. Esta intervención busca eliminar las poblaciones de triatominos dentro de las viviendas, cortando así la cadena de transmisión del parásito a los humanos. La estrategia enfatiza la necesidad de una evaluación post rociado, tanto entomológica (para verificar la reducción de la infestación) como serológica (para monitorear el impacto en la infección humana), para medir la efectividad de las intervenciones. Es importante destacar que la estrategia no se limita únicamente al control químico de los vectores. Reconoce la complejidad de la enfermedad de Chagas y la influencia de factores socioambientales en su transmisión. Por ello, se contemplan acciones complementarias como el mejoramiento de las viviendas para reducir los sitios donde los triatominos pueden anidar y reproducirse.
La participación activa de la comunidad también se considera un elemento crucial para el éxito de la estrategia, promoviendo la priorización sobre la enfermedad, sus mecanismos de transmisión y las medidas preventivas. Además de la interrupción de la transmisión vectorial intradomiciliaria, la estrategia aborda otras vías de transmisión, aunque con menor énfasis en el documento revisado. Se reconoce la importancia del tamizaje serológico obligatorio en bancos de sangre para prevenir la transmisión transfusional. Si bien no se detalla extensamente en este documento específico, es sabido que México ha implementado medidas para garantizar la seguridad de las transfusiones sanguíneas con respecto a la enfermedad de Chagas. Vale la pena mencionar que la estrategia también menciona la importancia de la detección oportuna y el tratamiento etiológico temprano de los casos de Chagas. Esto es fundamental para reducir la progresión de la enfermedad y prevenir complicaciones a largo plazo. Sin embargo, el documento se centra en la prevención de la transmisión, dejando los detalles del diagnóstico y tratamiento a otras directrices y programas.
Es importante reconocer que una estrategia nacional efectiva también debe considerar el fortalecimiento de la vigilancia epidemiológica, el diagnóstico temprano con pruebas moleculares, identificando en una etapa temprana el material genético del parásito en las personas y también en las chinches recolectadas identificando asertivamente el parásito en el vector, además del acceso al tratamiento para las personas afectadas, en un esfuerzo coordinado para controlar y, en última instancia, eliminar la enfermedad de Chagas como un problema de salud pública en México. Además, de contextualizar las acciones desde un enfoque multidisciplinario con actividades de investigación entre las partes operativas y académicas y con la participación de diversos sectores poblacionales, sin omitir su encuadre en el panorama internacional de esta enfermedad.
Tal y como lo recomienda la Guía para el diagnóstico y tratamiento de la enfermedad de chagas de la Organización Panamericana de la Salud (OPS 2018), esta estrategia se ve reforzada con el apoyo de dos fármacos recomendados a nivel internacional para el tratamiento etiológico de la enfermedad de Chagas: el Nifurtimox y el Benznidazol. La disponibilidad de ambos medicamentos, incluyendo las dos presentaciones de Benznidazol, como fármacos antiparasitarios que actúan directamente contra el T. Cruzi, amplían las opciones terapéuticas y permite adaptar el tratamiento a las necesidades específicas de cada paciente, considerando su edad, fase de la enfermedad y posibles comorbilidades.
México podrá avanzar significativamente en el control y la eventual eliminación de la enfermedad de Chagas como un problema de salud pública.
Referencias
- Centers for Disease Control and Prevention (CDC). (2024). Chagas disease (American trypanosomiasis): Prevention and control. https://www.cdc.gov/parasites/chagas/prevention.html
- Jiménez B., J. C. (2023, 28 de abril). Mantienen ruta inversa para control de Chagas. El Heraldo de Martínez. Recuperado de https://elheraldodemartinez.com.mx/estado/tlapacoyan/109642-mantienen-ruta-inversa-para-control-de-chagas-2.html
- Secretaría de Salud, Centro Nacional de Programas Preventivos y Control de Enfermedades. (2019). Manual de procedimientos para la enfermedad de Chagas en México. Recuperado de https://www.gob.mx/cms/uploads/attachment/file/447946/Manual_de_Procedimientos_para_la_Enfermedad_de_Chagas_en_Mexico.pdf
- Naciones Unidas México. (2022, abril 4). La OPS y Unitaid lanzan una alianza para avanzar en la eliminación de la transmisión de la malaria en la región. Naciones Unidas. https://mexico.un.org/es/188373-la-ops-y-unitaid-lanzan-una-alianza-para-avanzar-en-la-eliminaci%C3%B3n-de-la-transmisi%C3%B3n
- DNDial. (2019, noviembre 12). Seminario en Veracruz reúne profesionales y organizaciones para identificar las barreras al acceso al diagnóstico y tratamiento de la enfermedad de Chagas en México. https://dndial.org/es/releases/2019/seminario-en-veracruz-reune-profesionales-y-organizaciones-para-identificar-las-barreras-al-acceso-al-diagnostico-y-tratamiento-de-la-enfermedad-de-chagas-en-mexico
- Médicos Sin Fronteras. (2014, 9 de junio). Revolución en el diagnóstico de Chagas. Médicos Sin Fronteras en México y Centroamérica. https://www.msf.mx/actualidad/revolucion-en-el-diagnostico-de-chagas/
- Sánchez-Camargo, C. L., Albajar-Viñas, P., Wilkins, P. P., Nieto, J., Leiby, D. A., Paris, L., Scollo, K., Flórez, C., Guzmán-Bracho, C., Luquetti, A. O., Calvo, N., Tadokoro, K., Saez-Alquezar, A., Palma, P. P., Martín, M., & Flevaud, L. (2014). Comparative evaluation of 11 commercialized rapid diagnostic tests for detecting Trypanosoma cruzi antibodies in serum banks in areas of endemicity and nonendemicity. Parasitology, 52(7). https://doi.org/10.1128/jcm.00144-14
- Organización Panamericana de la Salud. (2020). Síntesis de evidencia: Guía para el diagnóstico y el tratamiento de la enfermedad de Chagas. Revista Panamericana de Salud Pública, 44, e28. https://doi.org/10.26633/RPSP.2020.28
- González-Guzmán, S., González-Cano, P., Bagu, E. T., Vázquez-Vega, S., Martínez-Salazar, M., Juárez-Montiel, M., Gutiérrez-Hoya, A., Crescencio-Trujillo, J. A., Sánchez-Montes, S., Fernández-Figueroa, E., Contreras-López, E. A., Guerra-Márquez, Á., Arroyo-Anduiza, C. I., Ángeles-Márquez, L. E., Rodríguez-Trejo, E., Bekker-Méndez, C., Guerra-Castillo, F. X., Regalado-Santiago, C., Tesoro-Cruz, E., Oviedo, N., Victoria-Jardón, A. M., Bautista-Olvera, J., García-Ramírez, P., Vázquez-Meraz, J. E., Contreras-Lozano, M. C., Castillo-Flores, V. S., Guevara-Reyes, R., Girón-Sánchez, A. R., Arenas-Luis, H. D., Pecero-Hidalgo, M. J., Ríos-Antonio, E., Ramírez-Pereda, N., Martínez-Mora, A., & Paredes-Cervantes, V. (2022). Seroprevalence of Trypanosoma cruzi in Eight Blood Banks in Mexico. Archives of Medical Research, 53(6), 625–633. https://doi.org/10.1016/j.arcmed.2022.04.004
- Gobierno de México. (2025). Boletín Epidemiológico Sistema Nacional de Vigilancia Epidemiológica/Sistema Único de Información: Número 13, Volumen 42, Semana 13, del 23 al 29 de marzo del 2025. Secretaría de Salud. Recuperado de https://www.gob.mx/cms/uploads/attachment/file/988378/sem13.pdf
- Centers for Disease Control and Prevention. (2022, April 11). Trypanosomiasis American (also known as Chagas Disease). U.S. Department of Health & Human Services. https://www.cdc.gov/dpdx/trypanosomiasisamerican/index.html
- Centers for Disease Control and Prevention. (2023, August 28). Preventing Chagas disease. U.S. Department of Health & Human Services. https://www.cdc.gov/chagas/prevention/index.html
- Shelly, E. M., Acuna-Soto, R., Ernst, K. C., Sterling, C. R., & Brown, H. E. (2016). A critical assessment of officially reported Chagas disease surveillance data in Mexico. Public Health Reports, 131(1), 59–66. https://doi.org/10.1177/003335491613100112
- Nepomuceno de Andrade, G., Bosch-Nicolau, P., Nascimento, B. R., Martins-Melo, F. R., Perel, P., Geissbühler, Y., Demacq, C., Quijano, M., Mosser, J. F., Cousin, E., Machado, Í. E., Rodrigues, M. L. A. C., Ribeiro, A. L. P., & Molina, I. (2024). Prevalence of Chagas disease among Latin American immigrants in non-endemic countries: An updated systematic review and meta-analysis. The Lancet Regional Health – Europe, 46, 101040. https://doi.org/10.1016/j.lanepe.2024.101040
- Organización Mundial de la Salud (OMS). (2020). Día Mundial de la Enfermedad de Chagas: 14 de abril. https://www.who.int/es/news-room/events/detail/2020/04/14/default-calendar/world-chagas-disease-day
- Organización Mundial de la Salud (OMS). (2023). Chagas disease (American trypanosomiasis). https://www.who.int/news-room/fact-sheets/detail/chagas-disease-(american-trypanosomiasis)
- Organización Panamericana de la Salud (OPS). (2020). Guía para el diagnóstico y el tratamiento de la enfermedad de Chagas. https://iris.paho.org/handle/10665.2/49653
- Organización Panamericana de la Salud (OPS). (2023). Enfermedad de Chagas. https://www.paho.org/es/temas/enfermedad-chagas
- Organización Panamericana de la Salud. (13 de abril de 2021). El 70% de las personas con Chagas no saben que están infectadas. Recuperado de https://www.paho.org/es/noticias/13-4-2021-70-personas-con-chagas-no-saben-que-estan-infectadas
- Peña-Callejas, G., González, J., Jiménez-Cortés, J. G., de Fuentes-Vicente, J. A., Salazar-Schettino, P. M., Bucio-Torres, M. I., Cabrera-Bravo, M., & Flores-Villegas, A. L. (2022). Enfermedad de Chagas: biología y transmisión de Trypanosoma cruzi. TIP. Revista Especializada en Ciencias Químico-Biológicas, 25, 1-19. https://doi.org/10.22201/fesz.23958723e.2022.449
- Rassi, A., Rassi, A., & Marin-Neto, J. A. (2010). Chagas disease. The Lancet, 375(9723), 1388–1402. https://doi.org/10.1016/S0140-6736(10)60061-X
- Velasco-Castrejón, Ó., & Rivas-Sánchez, B. (2008). Apuntes para la historia de la enfermedad de Chagas en México. Boletín médico del Hospital Infantil de México, 65(1), 17-28.
- Ventura-García, L., Roura, M., Pell, C., Posada, E., Gascón, J., Aldasoro, E., Muñoz, J., & Pool, R. (2013). Socio-cultural aspects of Chagas disease: A systematic review of qualitative research. PLoS Neglected Tropical Diseases, 7(9), e2410. https://doi.org/10.1371/journal.pntd.0002410

